glp-1药物呈现向多适应症扩展的趋势。其中,最为成熟的两大适应症是2型糖尿病(t2dm)与肥胖;其次,心血管疾病(cvd)、非酒精性脂肪性肝炎(nash)和慢性肾病(ckd)等关键细分领域适应症也已有较多管线布局;此外,阿尔茨海默病(ad)、帕金森病(pd)等领域适应症也有一定管线布局。除管线研发数据外,企业的生产及商业化能力也将对glp-1药物的盈利能力产生较大影响。本文对glp-1药物适应症市场、管线情况、生产与商业化进行深入研究和分析。
一、glp-1适应症分析
glp-1药物呈现向多适应症扩展的趋势,可治疗人群庞大,潜在市场空间广阔。其中,最为成熟的两大适应症是2型糖尿病(t2dm)与肥胖,兼具医疗和消费属性,形成稳定的收入支撑;其次,心血管疾病(cvd)、非酒精性脂肪性肝炎(nash)和慢性肾病(ckd)等关键细分领域适应症也已有较多管线布局;此外,阿尔茨海默病(ad)、帕金森病(pd)等机会性投资领域管线也有一定布局,一旦突破,临床意义较大。目前,2型糖尿病、肥胖与降低心血管风险已有相关靶点获批上市。
(一)2型糖尿病与肥胖是稳定收入及未来增长来源
目前,glp-1药物主要销售来源是2型糖尿病,2023年前三季度,全球glp-1药物的销售额中,糖尿病占比为81%,其中有一部分被超适应症用于肥胖的治疗。2023年,glp-1在全球糖尿病治疗处方中占比仅6%,2018~2022年其市场份额复合年均增长率(cagr)为29%,预期未来渗透率有望继续升高。
未来,全球glp-1市场的高速增长主要由减肥需求驱动,治疗肥胖或成为主要增长来源。截至2023年8月,全球减重药物市场的年销售额环比增速高达134%,年销售额达77亿美元。一方面,肥胖人群基数大(全球约7.64亿人),且治疗比例低(仅2%),glp-1在减肥方面的应用有望吸引更多未接受治疗的患者,销售额保持高速增长。以诺和诺德的wegovy(注射用,减重)为例,其在美国的患者中77%是新增的减重病人。另一方面,肥胖患者往往需要长期服药,单体需求量大。此外,非肥胖患者也有一定比例希望通过用药实现减重。据辉瑞预测,2030年美国glp-1药物销售额将超过900亿美元,其中减肥适应症销售额为500亿~550亿美元。
(二)拓展适应症关键细分领域中非酒精性脂肪性肝炎(nash)值得期待
1.glp-1的管线成功率
glp-1在研适应症中较为主流的关键细分领域包括心血管疾病(cvd)、非酒精性脂肪性肝炎(nash)和慢性肾病(ckd)等,均与2型糖尿病(t2dm)有较高关联。从流行病学来看,我国t2dm患者中cvd的总体患病率约34%,非酒精性脂肪性肝病(nafld)患病率约53%,其中nash患病率约10%,ckd患病率约20%。从疾病病理来看,cvd、nash、ckd与t2dm的疾病进展均与较高的低密度脂蛋白胆固醇水平相关。glp-1药物或可有效降低低密度脂蛋白(ldl),因而有较大潜能对cvd、nash、ckd等关联疾病发挥作用,对应管线成功率较高。如司美格鲁肽在select临床项目中有效降低超重与肥胖患者的mace风险并获批上市;在flow临床项目中对合并肾功能不全2型糖尿病患者和慢性肾病患者的疗效优异并提前终止。
2.cvd、ckd、nash现有治疗方案
cvd多通过手术治疗,并有多种可选药物辅助治疗。ckd可使用sglt2抑制剂治疗,可使ckd患者肾病进展或心血管死亡事件的相对风险降低28%~34%,较诺和诺德flow临床项目中司美格鲁肽降低24%更有竞争力。
nash患者群体较大,但长达40年无药可用,仅有一款药物——甲状腺激素受体β激动剂resmetirom于2024年3月获批。司美格鲁肽相较resmetirom实现更高比例的nash缓解(司美格鲁肽为59% ,resmetirom为 30%)和纤维化评分改善(司美格鲁肽为43%,resmetirom为 26%)。此外,fda为nash类药物设有加速获批标准,审批容易,nash适应症药物获批指日可待。
(三)潜在投资中阿尔茨海默病(ad)适应症机遇与风险并存
阿尔茨海默病(alzheimer's disease,ad)适应症赛道目前处于蓝海市场,动物模型证明glp-1可改善认知能力。目前,ad类疾病主要应用药物有胆碱酯酶抑制剂、谷氨酸受体拮抗剂和可溶性β淀粉样蛋白(amyloid-β,aβ)抗体类药物,代表产品有多奈呱齐、美金刚和lecanemab。前两者主要是改善疾病症状,仅有lecanemab一例可通过与aβ聚合体结合促进后者的清除,减缓病症进程。然而,aria(淀粉样蛋白相关影响异常)类副作用较为严重,礼来公司的类似产品donanemab的审批也是因此一拖再拖。glp-1用于ad适应症的研发仍有较大价值。
研发进展方面,诺和诺德2021年启动ad适应症的临床项目evoke plus,预计2026年底读出结果,进展稍显缓慢,存在一定风险。但是除aβ单抗开发成功外,绝大部分ad药物尚处于i、ii期的早期临床开发阶段,成药前景尚不明朗,glp-1药物在开发进度上并不落后于其它早期ad新药,承受的研发失败风险也相似。此外,glp-1对2型糖尿病、nash、ckd等慢性炎症相关疾病已有明确的临床疗效,因而在ad(神经炎症引发)领域或具有优势。
二、glp-1管线分析
(一)疗效数据
1.2型糖尿病
葡萄糖化血红蛋白(hba1c)由血清中的糖和血红蛋白形成,反映检测前2~3个月的血糖水平,与微血管并发症紧密相关,是2型糖尿病监测的重要指标。
glp-1相关管线在2型糖尿病适应症的临床设计使用hba1c为主要观察终点,根据其改善程度可以将疗效分为3个梯队。第一梯队包括替尔泊肽和玛仕度肽,hba1c水平较基线变化分别为-2.10%和-2.09%。第二梯队包括cagrisema、orforglipron、司美格鲁肽和retatrutide等,hba1c水平较基线变化在-1.32%~-1.8%之间。其中,orforglipron是口服司美格鲁肽。
2.减重适应症
减重适应症的临床试验使用较基线体重降低百分比作为主要终点。24~36周的短期临床试验中,玛仕度肽、retatrutide和amg133减重效果为第一梯队,体重较基线的平均百分比变化约15.4%~16.0%。相比之下,司美格鲁肽仅为8.0%。长期临床试验随访中,retatrutide的疗效最佳,48周减重可达22.1%;玛仕度肽、替尔泊肽和survodutide在48周减重可达16.7%~18.6%。相比之下,司美格鲁肽在第68周减重疗效为13.9%。
3.nash适应症
nash适应症的临床试验中,司美格鲁肽治疗72周后,nash得到缓解且纤维化未恶化的比例为59%(安慰剂组为17%)。retatrutide、efinopegdutide和pemvidutide临床试验以相对肝脏减脂率为主要终点,在治疗24周后,肝脏减脂率分别为82.4%、72.7%和76.2%,对比司美格鲁肽组为42.3%。
2型糖尿病、减重适应症和nash临床疗效第一梯队的管线多为多靶点设计,如替尔泊肽和amg133针对glp-1/gipr;玛仕度肽、efinopegdutide和pemvidutide针对glp-1/gcgr,retatrutide针对glp-1/gipr/gcgr。多靶点药物较单glp-1药物具有一定临床疗效优势。
(二)多肽结构设计与长效性
glp-1在多种适应症中均需要长期注射用药,然而受到体内二肽基肽酶4(dpp-4)和中性肽链内切酶(nep)降解和肾脏清除影响而具有较短的半衰期。因此,用药频次高,患者依从性差。医药产业界主要从提高dpp-4酶的耐受性和减少体内清除两方面延长半衰期,主要策略包括氨基酸替换、多肽脂酰化、融合蛋白、药物缓释和抗体偶联及融合等。
1.氨基酸替换
dpp-4的切割位点在glp-1序列的第二位置丙氨酸(ala),使用甘氨酸(gly)替换后可延长多肽药物半衰期,基于此设计的药物艾塞那肽和利西拉肽需每日注射。
2.多肽脂酰化
将脂肪酸以脂酰基的形式连接到肽链上,经过脂酰化修饰后的肽链可形成多聚体复合物,皮下注射后,药物会在注射局部形成堆积,延迟吸收,进入血液循环。进入血液后,从多聚体中解离的单体化合物,会因其脂/水两亲的特性和血浆白蛋白结合,增加多肽被dpp-4酶失活和肾小球滤过的空间位阻,并通过fcrn通路延长多肽药物的半衰期。基于此设计的司美格鲁肽仅需每周1次给药。
3.融合蛋白
在glp-1药物分子上融合白蛋白,白蛋白免疫原性低而具有较好的安全性,并可凭借其与fcrn的作用延长半衰期。基于此设计的阿必鲁肽仅需每周1次给药。
4.药物缓释
使用微球或聚合物水凝胶等对药物进行包裹,在体内缓慢释放也可延长半衰期。如以可生物降解聚合物为骨架材料,包裹蛋白多肽类药物制成注射微球,通过肌肉或皮下注射给药,随着聚合物的降解,药物释放。基于此设计的注射用艾塞那肽plga微球可每周1次给药,但单独的艾塞那肽需每日给药。在研的水凝胶释放系统在动物实验中可保持长达6周的治疗浓度,有望将glp-1注射频率降低至每年3次。
5.抗体偶联及融合
将靶向glp-1r抗体或与功能性激活glp-1r的glp-1相偶联或融合,可有效降低其脱靶效应,提高亲和力和药效,也可提升多肽的稳定性并延长半衰期。regeneron基于此设计的药物减重效果达8周,或可实现每月给药。
(三)口服药物设计策略和疗效
尽管glp-1药物已从短效迭代至长效,但每周1次的注射频率仍无法带来好的用药体验。对于糖尿病、肥胖这类慢性病,口服的便利性和依从性优势不言而喻。目前,glp-1口服药物主要分为两类:一类是多肽药物使用递送技术实现口服,一类是小分子药物。
多肽口服需要借助载体递送,穿过胃酸、胃肠道酶、肠道黏膜、肠道上皮细胞等多个屏障才能被吸收,肠道吸收后进入血液循环,再分布到作用部位,最终能发挥疗效的活性药物量极具不稳定性,因此生物利用度成为制约多肽口服化的关键性因素。目前,唯一上市的口服多肽glp-1药物口服司美格鲁肽,需每日服药,服药条件严格,便捷性不足,其多肽生物利用度仅0.4%~1%,用药剂量远超皮下注射,成本高。目前,多肽口服技术尚未实现口服的便利性和依从性要求。
小分子glp-1激动剂筛选难度高,但具有稳定性优势,可实现口服,且具有成本和产能优势。glp-1r属于b类g蛋白偶联受体(gpcr),其正构位点高度保守,难以实现高选择性,而且受体与多肽的结合模式以及激活机制复杂,其小分子配体开发壁垒较高。小分子较多肽有天然的稳定性优势,适配口服给药方式。此外,目前glp-1多肽原料药由于使用固态多肽合成的方式生产,按批次体积进行,环节众多,因而难以提升产能。但小分子生产则通过液相合成,成本低、易生产。目前,在研的口服glp-1中,礼来公司的orforglipron小分子疗效与第一、二梯队的注射类用药相当,略优于诺和诺德的口服司美格鲁肽。然而,小分子glp-1药物的不良反应较多肽类严重,主要的不良反应包括恶心、腹泻和呕吐,很大程度上影响患者的用药体验和依从性,尤其是对减重患者影响更大。orforglipron在2型糖尿病实验中因不良反应停药的患者占比达12.7%~14.8%,高于口服司美格鲁肽的4.0%~7.4%。辉瑞研发的小分子danuglipron因不良反应停药率达34%而暂停临床,另一小分子lotiglipron因转氨酶升高(潜在肝脏损伤)而终止临床。
总的来说,小分子glp-1具有用药便利、低成本、产能大、疗效相当的优势,但安全性存在不足。若能在安全性方面实现突破,市场竞争力将不容小觑。
三、glp-1生产与商业化
除管线情况外,企业的生产及商业化能力也将对glp-1药物的盈利能力产生较大影响。
(一)glp-1多肽药物产业链上游需求庞大,中下游cdmo产能扩展面临痛点
考虑到glp-1多肽药物在糖尿病、减重领域市场的快速扩张,以及未来潜在的nash等其他领域应用场景,glp-1多肽药物产业链下游对于上游原料药需求较大。
随着glp-1多肽药物需求的增长,产能需求将以更大幅度增长。药企需在前期与cdmo建立合作,迅速提高产能,后期通过自建产能降低成本并提高对生产的控制能力。但多肽药企、多肽cdmo现阶段的产能扩展仍然面临痛点。一方面,多肽药物产能构建周期非常长,终端产品品类繁多,短期内很难扩展出来。另一方面,现阶段多种多肽剂型的生产工艺还不成熟,大量环节有待探索、验证。此外,有企业尝试用合成生物学的方法来提高多肽生产效率,但由于glp-1的制备涉及修饰,可能引入杂质,分离、纯化的难度比较大,合成生物学的路径也还在探索中。
(二)已上市专利或将面临仿制药冲击,未上市专利或将大量进入临床
商业化情况很大程度受专利有效期影响,应关注企业核心专利的有效期和相关专利队列的布局。glp-1靶点相关的已上市药物基本都将在未来3年内面临核心化合物/序列专利到期的境况,届时创新药的市场可能会受到大量生物类似药或仿制药上市的冲击。另一方面,未上市的ⅲ期临床之后和即将上市的创新药的核心专利保护期都还很长,同时还有大量处于临床前研究或在临床申请的品种正在积极进行中,在未来1~3年内可能有大量品种进入临床。
四、医药商务拓展(bd)交易尽职调查要点分析
glp-1药物的潜力催生了商务拓展(business development,bd)交易,针对nash等适应症需启动复杂而庞大的系列iii期临床试验,全球只有mnc有能力操作,所以通常在研发中后期需要考虑bd交易机会。
作为医药企业一个重要的功能部门,bd的作用主要有三方面:一是药企在自研基础上,通过bd对外授权为公司创造营收,及引入新的技术成果扩充管线;二是适时配置新项目做补充,对冲新药研发的风险;三是在资源充足的情况下,通过bd切入新的市场。知识产权作为bd交易的核心标的,对其进行尽职调查至关重要,主要包括核心专利的稳定性分析以及知识产权在被许可区域内的自由实施的分析。
医药bd交易尽职调查通常关注企业的研发能力、生产能力和商业化能力三大维度。
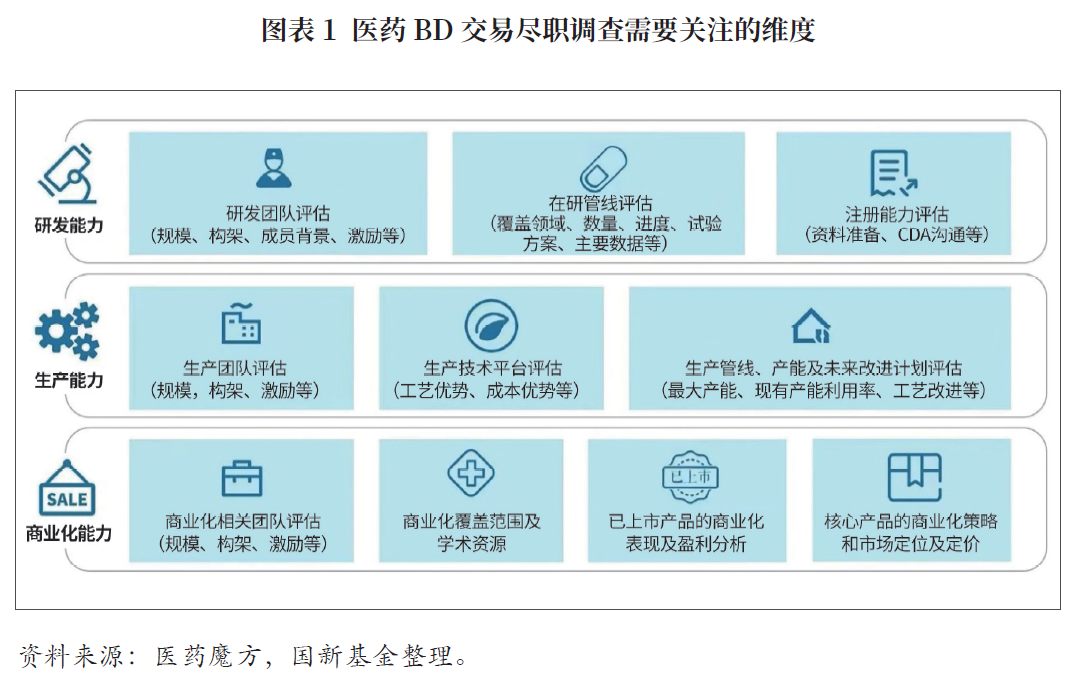
研发能力评估包括研发团队评估、在研管线评估及注册能力评估。最终聚焦两个关注点:一是公司整体技术实力如何,这关系到未来能否持续拓展新品种;二是公司在研品种临床结果如何以及未来的上市进程。如果临床数据和产能良好会进入技术监管环节,尽调全部研发数据。
生产能力评估包括生产团队评估、技术平台评估及管线产能和未来改进计划评估。最终聚焦两个关注点:一是生产成本;二是公司未来产能和供应的稳定性。在生产部分,评审机构最关注原始记录、原始资料的资质等。尽调实操通常先关注批次记录做了哪些临床试验,每个临床试验用了几批临床供试品,批号是哪些,将这些批号与相应的制剂、原料药、中间体等对应,还会关注批次的稳定性研究。
尽调环节的商业化考量点第一是团队,尤其产品在早期时,设计临床试验要具备商业化意识,例如未来产品如何定位,核心竞争对手情况。一些有已上市产品的团队,需要详细评估目前团队规模构架和渠道覆盖,以及是否将核心产品与未来销售策略相匹配。第二是商业化覆盖,最为典型的是医院覆盖,这一方面取决于产品的准入能力,另一方面也取决于医院能够实现的产品目标患者覆盖率。第三是已上市产品的商业化表现和盈利分析。第四是核心产品的商业化策略、市场定位及定价。
通常而言,并购交易、医药资产和权益买断、成立合资公司等bd交易类型可以发生在医药产业链的任何一个环节,无论上中下游公司都有扩大生产规模、共同合作分担风险的需求。许可交易和药品研发合作、“许可 股权投资”则主要发生在医药上中游的科研服务和生产制造环节,此时正处于新药临床研发和商业化的前夕,产品尚未完全进入医药流通领域,进行许可交易、药品研发合作可以充分发掘产品潜力,实现各方利益最大化。
五、相关机遇
(一)关注新适应症开发带来的新增长点及多靶点glp-1药物
glp-1药物挖掘出许多新适应症,为更多患者带来福音的同时也带来新的增长点,建议关注nash、ad等细分领域,重点关注可降低低密度脂蛋白(ldl)的glp-1管线,以及神经炎症引发的ad领域的glp-1管线。
多靶点药物较单glp-1药物具有一定临床疗效优势,双靶点、三靶点设计有望进一步提升疗效,可关注多靶点管线并对比现有主流管线临床数据进行判断。
(二)关注长效注射药物及小分子口服药物
作为注射用药,glp-1多肽的产品渗透率和患者依从性与使用频率密切相关。可关注给药频率至少在1周以上的glp-1管线。此外,也可关注比肩主流第一、二梯队疗效,并且安全性好、不良反应比例低的小分子口服glp-1药物。
(三)关注国内glp-1多肽药物产业链
随着glp-1多肽药物下游市场快速放量,药企对多肽产能以及上游原料药的需求较大,可关注国内glp-1多肽药物产业链具备足够进化能力的头部企业。
(国新基金)
注释
数据来源:招银国际。
数据来源:iqvia,诺和诺德。
〔3〕 数据来源:van den oord sc,sijbrands ej,ten kate gl,et al. carotid intima media thickness for cardiovascular risk assessment:systematic review and meta-analysis[j]. atherosclerosis,2013,228(1):1-11。
〔4〕 数据来源:方凤贞,李壮苗,陈婷玉.2型糖尿病患者发生糖尿病肾脏疾病危险因素的系统评价[j].中国全科医学,2021,24(33):4261-4267。
〔5〕 不良心血管事件。
〔6〕 数据来源:礼来产品恩格列净。
〔7〕 数据来源:阿斯利康产品达格列净。
〔8〕 一种可生物降解聚合物,聚乳酸-羟基乙酸共聚物(poly(lactic-co-glycolic acid))。
〔9〕 glp-1受体。
免责声明
本文的分析及建议所依据的信息均来源于公开资料,我们对这些信息的准确性和完整性不作任何保证,也不保证所依据的信息和建议不会发生任何变化。我们已力求文章内容的客观、公正,但文中的观点、结论和建议仅供参考,不构成任何投资建议。投资者依据文章提供的信息进行投资所造成的一切后果,概不负责。文章未经书面许可,任何机构和个人不得以任何形式翻版、复制和发布。如引用、刊发,需注明出处为国新资讯,且不得对文章进行有悖原意的引用、删节和修改。
- 集成电路关键“卡脖子”环节 ——光掩模版行业浅析2024-10-17
- 具身智能技术发展现状与相关机遇2024-10-17
- 算力互连技术发展趋势分析及 相关机遇展望2024-09-25
